Crimes da Pfizer contra nossas crianças: parada cardíaca de bebê de dois meses uma hora após vacina experimental
58 bebês que receberam vacinas de mRNA COVID-19 sofreram eventos adversos com risco de vida

Nota do Editor de Pesquisa Global
Leia cuidadosamente. A Pfizer está cometendo crimes contra a humanidade, especificamente contra nossas crianças.
A vacina resultou em parada cardíaca não em uma pessoa idosa, mas em um bebê de dois meses.
“Por que eles não acompanharam a condição do bebê de 2 meses, após entrar em parada cardíaca uma hora depois de receber uma vacina experimental? Por que não há mais informações? É porque ele morreu? Ou o bebê foi removido de um experimento? Por que o autor do relatório não mencionou isso?”
Apelamos ao Departamento de Justiça dos EUA para realizar uma investigação criminal contra a Pfizer.
Apelamos aos governos em todo o mundo para suspender imediatamente a vacina de mRNA.
Uma ação coletiva também é necessária em nome das centenas de milhares de vítimas da vacina mRNA.
Nunca mencionada pela mídia, a Pfizer tem antecedentes criminais no Departamento de Justiça dos EUA.
Em 2009, a Pfizer foi indiciada por acusações de “marketing fraudulento”.
Michel Chossudovsky , Pesquisa Global, 6 de julho de 2022
***
Uma análise dos relatórios do VAERS mostra que, ao contrário do documento informativo da FDA, alegando que a maioria dos eventos adversos no ensaio clínico da Pfizers não foi grave – pelo menos 58 casos de efeitos colaterais com risco de vida em crianças menores de 3 anos que receberam vacinas de mRNA foi reportado. Para alguns, não está claro se eles sobreviveram. Também não está claro por que os bebês foram vacinados e se fizeram parte dos ensaios clínicos. No entanto, na próxima reunião da FDA na quarta-feira, a FDA não poderá argumentar que não sabia
"Dor no peito; paragem cardíaca; Pele fria e pegajosa”. Esta breve descrição de uma parada cardíaca, que ocorreu uma hora após o recebimento de uma vacina Pfizer-BioNTech COVID-19, é retirada do sistema VAERS – o Sistema de Notificação de Véspera Adversa de Vacinas dos EUA ( caso número 1015467 ), e não se refere a um pessoa idosa, nem a um jovem adulto, ou mesmo a um adolescente. É difícil de acreditar, mas este relato se refere a um bebê de dois meses .
“Um paciente do sexo masculino de 2 meses de idade recebeu bnt162b2 (PFIZER-BioNTech COVID-19 VACCINE) número de lote: EL 739, através de uma via de administração não especificada em 02 de fevereiro de 2021 em dose única para imunização COVID-19”, assim declarado no relatório. “A vacinação administrada pelo paciente, observada por 15 minutos, saiu da clínica e retornou uma hora depois em 02 de fevereiro de 2021, apresentando-se como pele fria, úmida e com dor no peito, evento de parada cardíaca desenvolvido, paciente estabilizado e transferido para tratamento médico adicional… O resultado dos acontecimentos era desconhecido. Este caso foi relatado como grave com critérios de gravidade com risco de vida por HA. Não são possíveis tentativas de acompanhamento. Nenhuma informação adicional esperada”.
Como um bebê de 2 meses recebeu a vacina de mRNA? Essas vacinas ainda não receberam EUA (autorização de uso de emergência) para uso aprovado em crianças de cinco anos ou menos pelo FDA ou qualquer outra autoridade reguladora e, mesmo que receba, os EUA incluirão apenas bebês com 6 meses ou mais.
Este bebê participou dos ensaios clínicos da Pfizer-BioNTech, testando eficácia e segurança entre bebês?
A resposta não é clara. De acordo com a pessoa que escreveu o relatório “Não tenho certeza se o paciente foi inscrito no ensaio clínico”. No entanto, o autor do relatório também afirma que o relatório foi “ recebido de um outro profissional de saúde contactável pela Pfizer da Agência Reguladora” . Esta nota implica que a criança pode ter realmente participado do teste da Pfizer. O relatório da agência reguladora Safety Report Unique Identifier GB-MHRA-ADR 24687611 – indica que o relatório veio da Grã-Bretanha (as 2 primeiras letras no ID do relatório representam o país de origem, GB- Grã-Bretanha e MHRA indicam que a fonte de relatar era sua 'autoridade de drogas).
Por que eles não acompanharam a condição do bebê de 2 meses, após entrar em parada cardíaca uma hora após receber uma vacina experimental? Por que não há mais informações? É porque ele morreu? Ou o bebê foi removido de um experimento? Por que o autor do relatório não mencionou isso?
Surpreendentemente, verifica-se que este incidente não é isolado, mas de fato um dos muitos no sistema VAERS, descrevendo bebês e crianças menores de cinco anos expostos a vacinas de mRNA Covid, que sofreram reações adversas com risco de vida.
Embora crianças menores de cinco anos não fossem consideradas elegíveis para essas vacinas, a menos que fizessem parte de um ensaio clínico, surpreendentemente, parece que há muitos relatórios no sistema descrevendo bebês e crianças pequenas que foram vacinadas. Algumas das crianças sofreram de eventos adversos com risco de vida. Em alguns casos, não está claro o que aconteceu com eles; sobreviveram e se recuperaram, ainda sofrem de problemas de saúde ou morreram.
Em alguns dias, em 15 de junho, o Comitê Consultivo de Vacinas e Produtos Biológicos Relacionados da FDA discutirá os pedidos da Moderna e da Pfizer nos EUA para vacinas para bebês e crianças de 6 meses a 4 anos – o único grupo ainda não elegível para a vacinação COVID-19 hoje.
De acordo com o documento informativo da FDA divulgado hoje antes da reunião dos comitês do VRBPA, houve “245 relatórios dos EUA” para o sistema VAERS “em crianças de 6 meses a 4 anos de idade”, que foram injetadas (“produto administrado a paciente de idade” ou “uso off-label”) ou expostos à vacina “através do leite materno”. No entanto, ambas as empresas anunciaram já em maio que suas descobertas indicam que suas vacinas são seguras e eficazes.
O Documento Informativo VRBPAC lista uma variedade de eventos adversos relatados após a exposição à vacina nesta faixa etária, incluindo “pirexia…, temperatura corporal…, tosse, dor de cabeça, erupção cutânea, diarreia” . De acordo com o documento, “entre as notificações de VAERS dos EUA para indivíduos com idades entre 6 meses e 4 anos, que podem refletir o uso não autorizado da vacina ou podem refletir um erro de notificação, a maioria (96,3%) não foi grave”.
Embora o documento especifique preocupações de segurança identificadas a partir de dados de vigilância de segurança pós-autorização no VAERS, incluindo anafilaxia, miocardite e pericardite, ele não se relaciona a essas preocupações de segurança identificadas na faixa etária mais jovem. Em vez disso, afirma: “Não foram identificadas frequências, agrupamentos ou outras tendências incomuns para eventos adversos que sugerissem uma nova preocupação de segurança”.
Mas será que é mesmo assim? Parece que, independentemente dos resultados, e apesar das descobertas perturbadoras e chocantes que estão sendo expostas nos documentos da Pfizer, espera-se que ambas as empresas recebam os EUA desejados muito em breve. De fato, o site do CDC, já em abril, havia divulgado um protocolo sobre vacinação infantil , que incluía bebês de 6 meses a 4 anos também.
Diante dessa expectativa de aprovação, a Revista RT realizou uma análise dos casos notificados no sistema VAERS referentes a bebês de até 3 anos.
Durante a análise, foram retirados casos em que se afirmava que a exposição à vacina se deu por meio do aleitamento materno (esses casos foram analisados separadamente e em breve serão apresentados em artigo de acompanhamento), bem como casos que foram identificados como erros de o registro de idade.
A análise mostra que houve pelo menos 58 casos de reações adversas graves e com risco de vida entre bebês e crianças de 3 anos ou menos. Essa descoberta é especialmente intrigante, considerando o fato de que eles não deveriam ser vacinados nessa idade para começar. Infelizmente, de forma semelhante ao caso relatado acima, a maioria dos relatórios do VAERS não indica como e em quais circunstâncias eles foram expostos à vacina – eles participaram dos testes das empresas? E se não, por que e em que circunstâncias foram vacinados?
Ambas as empresas ainda não divulgaram os dados de segurança de seus testes nessa faixa etária. No entanto, uma coisa fica clara nos relatórios do VAERS: houve muitos bebês que ficaram feridos após receber a vacina. Independentemente de terem sido vacinados nos testes ou ilegalmente em suas comunidades, a Pfizer e a Moderna certamente não poderão afirmar, ao apresentar seus dados ao FDA, que a vacina é segura para bebês,e que não houve eventos adversos graves nessa faixa etária. Além disso, os especialistas do comitê da FDA que discutirão a aprovação dos EUA não poderão ignorar esses casos e argumentar que não sabiam. Os dados apresentados neste artigo demonstram, sem sombra de dúvida, o completo oposto, e desta vez – esses dados são apresentados ao público com antecedência, antes da concessão dos EUA e antes da discussão do VRBPAC.
O resultado dos eventos: Não se recuperou
Um dos relatos mais arrepiantes refere-se a uma bebê do sexo feminino de 43 dias, que em 30 de janeiro de 2021 recebeu a vacina Comirnaty da Pfizer. Na descrição do incidente (relatório nº 1133837) consta claramente que ela foi vacinada e que a vacina foi injetada no músculo : EK9788) como DOSE ÚNICA para imunização COVID-19” . Logo após a vacinação, o bebê sofreu uma variedade de lesões multissistêmicas com risco de vida, como“Reação anafilática (ampla), Asma/broncoespasmo (estreita), Síndrome anticolinérgica (ampla), Depressão respiratória central aguda (ampla), Hipertensão pulmonar (ampla), Cardiomiopatia (ampla), Pneumonia eosinofílica (ampla), Distúrbios vestibulares (ampla) , Hipersensibilidade (ampla), Insuficiência respiratória (estreita), Reação medicamentosa com eosinofilia e síndrome de sintomas sistêmicos (ampla) ”. Embora na seção de relato de óbito a declaração indique “Não”, a seção de relato de recuperação também afirma “Não” – o que significa que o bebê não se recuperou. O que então aconteceu com ela? Ela está viva ou ela morreu?
Além disso, este relatório, como muitos outros, levanta algumas questões difíceis. Como um bebê de 43 dias recebeu uma vacina ainda não aprovada para uso em bebês? Além disso, os atuais ensaios clínicos realizados devem incluir bebês e crianças com mais de 6 meses. Este bebê participou do teste da Pfizers? O relatório não responde a esta questão.
Assim como este bebê, verifica-se que, na maioria dos casos relatados, vários efeitos colaterais com risco de vida foram registrados para o mesmo bebê. Os eventos adversos graves mais comuns foram hemorragia perigosa; choque anafilático – uma alergia com risco de vida que pode danificar o sistema respiratório e causar tontura, desmaio e até morte; síndrome anticolinérgica - uma condição que ocorre quando os locais do receptor do neurotransmissor acetilcolina são bloqueados, o que pode levar a problemas de coordenação, aumento da frequência cardíaca e outros sintomas; encefalite – uma infecção cerebral, que pode causar dores de cabeça, vômitos, perda de consciência e morte; hipoglicemia – açúcar no sangue muito baixo, uma condição que pode rapidamente levar à morte em bebês; e síndrome neuroléptica – que também é fatal e pode danificar os músculos do coração, outros músculos,
Do resumo dos achados da análise segundo grupos de idade e gênero, surge o seguinte quadro:
Na faixa etária de 0 a 6 meses – há 28 notificações, sendo 10 do sexo masculino, 16 do feminino e 2 cujo sexo não foi especificado.
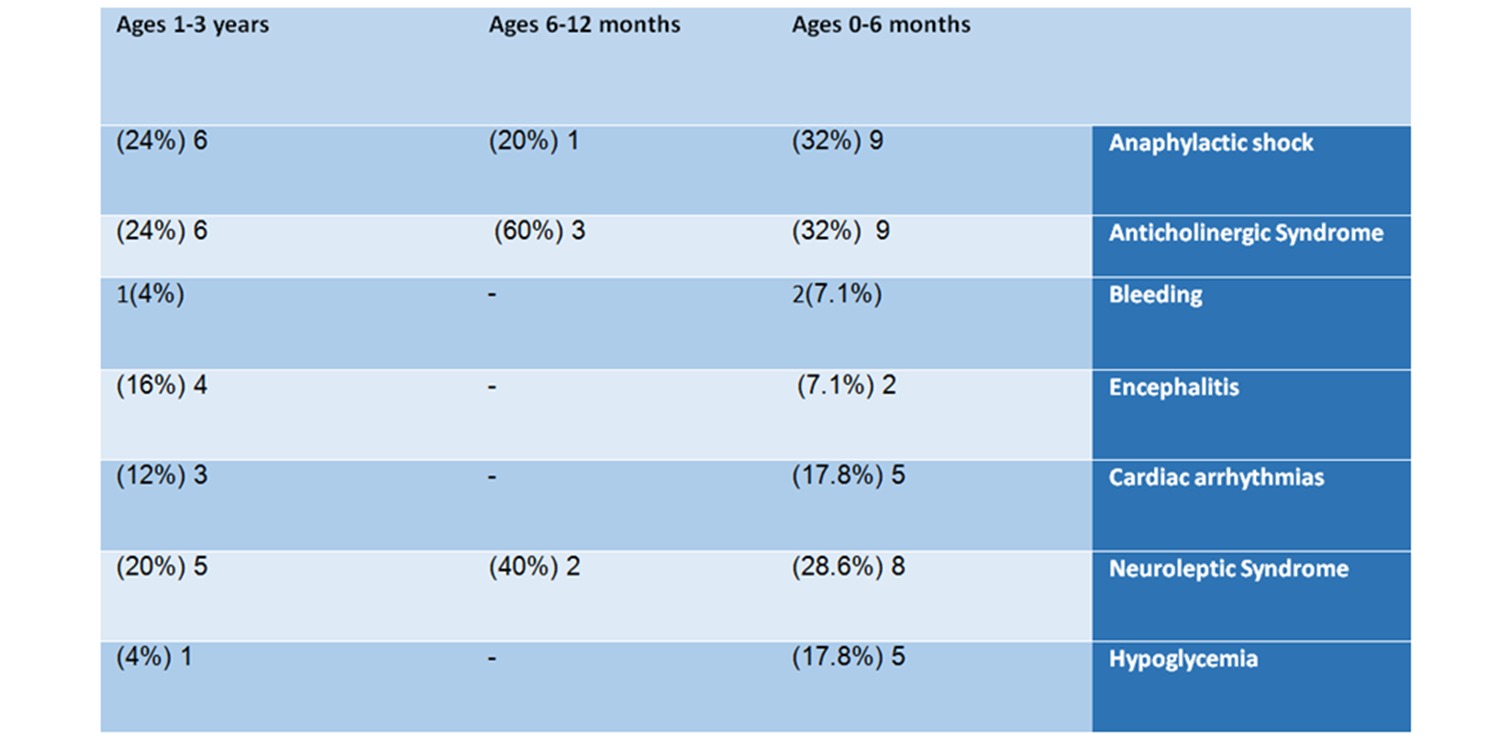
9 (32%) sofreram síndrome anticolinérgica, 9 (32%) choque anafilático, 8 (28,6%) síndrome neuroléptica, 5 irregularidades do ritmo cardíaco e 5 hipoglicemia.
Na faixa etária de 6 a 12 meses – neste grupo foram encontrados 5 relatos – 3 do sexo masculino, um do sexo feminino e um cujo sexo não foi especificado. Este grupo é pequeno em comparação com os outros grupos. A lista de reações adversas incluiu: choque anafilático, síndrome anticolinérgica e síndrome neuroléptica.
Na faixa etária de um a três anos – neste grupo foram notificados 25 casos, dos quais 5 relacionados ao sexo masculino, 19 relacionados ao sexo feminino e um a um bebê cujo sexo não foi especificado.
6 dos bebês (24%) tiveram choque anafilático, 6 (24%) sofreram síndrome anticolinérgica, 5 (20%) sofreram síndrome neuroléptica, 4 (16%) sofreram encefalite, 3 (12%) tiveram batimentos cardíacos irregulares, um bebê estava com hemorragia e um sofria de hipoglicemia.
Deve-se notar que os eventos adversos listados acima são apenas alguns dos relatados no VAERS em relação aos bebês. Optamos por nos concentrar apenas em eventos adversos comuns e com risco de vida.
Tabela nº 1: Análise dos relatos por idade e sexo
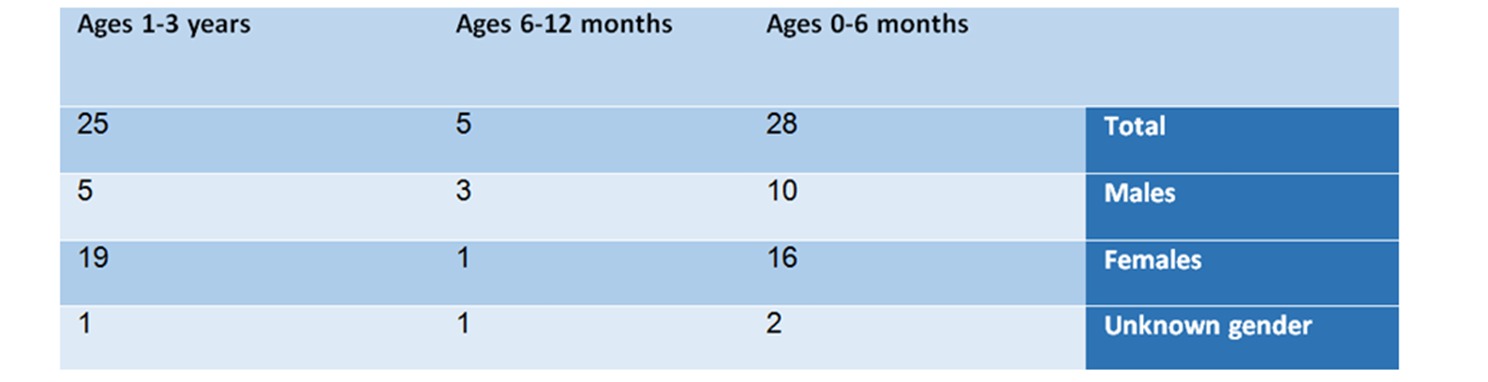
Tabela nº 2: Análise de notificações por eventos adversos
Os bebês estão vivos?
À semelhança do caso anterior descrito, outra bebé, de dois meses, também passou por choque anafilático após ter sido exposta a uma dose única da vacina Pfizer-BioNTech a 6 de janeiro de 2021, e tal como ela, segundo o relatório (n. 976433), ela sofria de uma série de sintomas multissistêmicos. Em relação ao método de administração da vacina, foi declarado “por via de administração não especificada” , o que significa que não está claro em que circunstâncias o bebê foi exposto à vacina.
Ela fez parte do ensaio clínico da Pfizers? Mais uma vez, não está claro no relatório.
No entanto, a pergunta mais importante que deve ser feita, assim como no caso anterior, é o que aconteceu com o bebê? Ela sobreviveu? Ela está viva?
E novamente, na seção que relata a morte, diz “Não”, significando que o bebê não morreu. No entanto, na descrição do relatório diz: “O paciente não havia se recuperado do evento. Não são possíveis tentativas de acompanhamento. Nenhuma informação adicional esperada”.
É difícil de acreditar, mas essa questão básica – o que aconteceu com um bebê após sofrer reações adversas tão graves e com risco de vida – também surge de outros casos graves, como o caso de um bebê de 6 meses (relatório nº 2084418 ) que “recebeu bnt162b2 (COMIRNATY), intramuscular” em 29 de dezembro de 2021, e passou por choque anafilático, síndrome anticolinérgica, síndrome neuroléptica, pneumonia infecciosa, outras infecções e sintomas multissistêmicos.
Também neste caso, a seção que relata a morte diz “Não”, significando que supostamente o bebê não morreu, enquanto na descrição do evento diz “resultado 'desconhecido'... Não são possíveis tentativas de acompanhamento. Não são esperadas mais informações”.
Em outro caso (relatório nº 1012508), um bebê de um ano que também recebeu uma vacina da Pfizer, em 19 de janeiro de 2021 (neste caso, é especificado que o bebê não participou de um teste) desenvolveu uma dor orelha esquerda que evoluiu para paralisia total, que foi diagnosticada como síndrome de Guillain Barre. Na descrição do caso constava que o bebê sofria de Síndrome de Guillain Barre, paralisia facial, encefalite não infecciosa, meningite não infecciosa, dores de ouvido e distúrbios auditivos. No entanto, no resumo do relatório, foi escrito, novamente, que “Nenhuma tentativa de acompanhamento é possível”.
E outro caso chocante (relato número 1379484) surge do relato de um bebê de apenas um mês de idade que sofreu “Sangramento vaginal/Sangramento vaginal constante e pesado com pedaços de coágulo” no dia seguinte após receber a vacina Pfizer-BioNTech em maio 19 de 2021.
Embora os sintomas do bebê tenham sido definidos como “graves como medicamente significativos” , na descrição do incidente afirma-se que o resultado é “desconhecido” e que “Não são possíveis tentativas de acompanhamento. Não são esperadas mais informações”.
Conforme mencionado, em alguns dos casos afirma-se que os bebês não fizeram parte de um ensaio clínico, enquanto em outros não está claro se eles participaram de um ensaio clínico ou foram vacinados em outras circunstâncias desconhecidas. Mas se eles fizeram parte do julgamento ou não, o relatório não explica a ausência dessa informação crítica; o que aconteceu com esses bebês? Eles sobreviveram? E se sim, eles se recuperaram? Por que não houve acompanhamento da condição médica de bebês que sofreram eventos adversos graves e com risco de vida, enquanto foi claramente declarado que eles não se recuperaram? Em casos tão graves, a FDA não exige que a empresa faça todos os esforços para localizar esses bebês, descobrir qual é sua condição e acompanhá-los?
“Vermelhidão na área da injeção: o protocolo do ensaio clínico não menciona reações adversas graves”
O comunicado de imprensa emitido em 11 de fevereiro de 2022, no qual a Pfizer-BioNTech anunciou que pretende solicitar à FDA aprovação para bebês de 6 meses a 4 anos de idade, as descobertas de segurança dos ensaios clínicos da empresa em bebês e crianças pequenas em essas idades não são mencionadas, nem mesmo em uma palavra. O folheto informativo sobre os ensaios clínicos que testam a segurança e eficácia da vacina Pfizer em adultos, crianças e bebês, no site da FDA, afirma claramente "Nenhum resultado do estudo publicado no ClinicalTrials.gov para este estudo". E, como observado acima, o recém-lançado The VRBPAC Briefing Document lista apenas um punhado de eventos adversos não graves relatados nessa faixa etária, incluindo e conclui que não há nada que sugira uma nova preocupação de segurança. Como a FDA poderia não saber de tantos eventos adversos graves que foram relatados aos sistemas de notificação do CDC? Alternativamente, se eles sabem sobre eles – por que eles os estão ignorando?
Como os eventos adversos em bebês foram testados do que nos ensaios clínicos? Em uma tentativa de responder a essa pergunta crítica, destinada a abordar as questões de segurança e garantir aos pais que a vacina é segura para bebês, examinamos o protocolo do estudo encontrado no site de ensaios clínicos da FDA.
Parece que nenhum evento adverso grave potencial foi listado. A lista de eventos adversos potenciais que o estudo deveria avaliar de acordo com o protocolo (“medida de resultado”) incluiu reações locais e sistêmicas. No entanto, estes são eventos adversos relativamente não graves.
A lista de eventos adversos locais que o estudo deveria monitorar inclui: “Dor ou sensibilidade no local da injeção, vermelhidão e inchaço”, e as reações sistemáticas incluíram “Febre, fadiga, dor de cabeça, calafrios, vômitos, diarreia, nova ou piora dores musculares, dores articulares novas ou agravadas, diminuição do apetite, sonolência e irritabilidade”. Além disso, embora o estudo esteja programado para terminar apenas em 14 de junho de 2024, o prazo estabelecido para examinar os eventos adversos é limitado a sete dias após cada uma das doses – a primeira e a segunda dose.
A vacina é ineficaz em bebês. A solução: diminuir o limite de eficiência e adicionar uma terceira dose
Além das preocupações substanciais em relação à segurança das vacinas para bebês, sua eficácia nessa faixa etária é questionável em geral. De acordo com os dados disponíveis, crianças saudáveis têm risco quase zero de doença grave, hospitalização ou morte devido ao COVID-19.
A hospitalização por COVID-19 é muito rara entre as crianças, e os casos de morte são ainda mais raros. Na Alemanha, por exemplo, um grande estudo descobriu que nem mesmo uma criança morreu de COVID-19 na faixa etária de 5 a 11 anos sem condições pré-existentes. Nessas circunstâncias, mesmo um caso de evento adverso grave, que dirá morte, é crucial e supera qualquer possível benefício da vacina.
Não surpreendentemente, os ensaios clínicos da Pfizer em bebês com menos de 4 anos provaram que 2 doses de vacina não aumentam significativamente sua contagem de anticorpos. A comissária da FDA, Dra. Janet Woodcock, admitiu em uma entrevista no início de abril de 2022 que “os anticorpos que foram desenvolvidos não eram tão altos, então eles não tiveram a mesma resposta de anticorpos à série de dois tiros nas crianças mais velhas. Não foi tão alto quanto esperávamos para os mais novos, como foi para os mais velhos”. De acordo com Woodcock, é por isso que a Pfizer, que planejava solicitar a aprovação dos EUA para bebês em fevereiro, adiou a data de envio e decidiu adicionar uma terceira dose ao teste e aguardar os resultados depois que todos os bebês receberam sua terceira dose.
Além disso, em uma declaração dada em 11 de maio, o Dr. Peter Marks, diretor do Centro de Avaliação e Pesquisa Biológica da FDA, anunciou que as vacinas para bebês e crianças não precisarão passar a taxa de eficácia de 50% contra o Covid. Uma taxa de eficácia de 50% é o limite que as vacinas para adultos precisam passar. No entanto, Marks explica que, apesar das diretrizes anteriores, o FDA não negará às empresas agora a aprovação para bebês e crianças pequenas apenas porque não atingiu a eficácia de 50% na prevenção de infecções sintomáticas.
A Pfizer divulgou um comunicado à imprensa em 23 de maio anunciando que “a eficácia da vacina de 80,3% foi observada na análise descritiva de três doses durante um período em que o Omicron era a variante predominante”. De acordo com o comunicado de imprensa, “o estudo sugere que uma dose baixa de 3 ug da nossa vacina … fornece às crianças um alto nível de proteção contra as recentes cepas COVID-19”.
No entanto, o documento informativo da FDArevela que a alegação de “alto nível de proteção” é baseada em um total de 10 casos sintomáticos de COVID-19 identificados no estudo, que ocorreram pelo menos 7 dias após a dose 3. Três deles ocorreram entre os participantes de 6 a 23 meses de idade (que incluiu 555 participantes – 376 no grupo da vacina e 179 no grupo do placebo) – com 1 caso no grupo da vacina Pfizer-BioNTech e dois no grupo placebo. Sete outros casos ocorreram entre os participantes de 2-4 anos de idade (que incluíram 860 participantes – 589 no grupo da vacina e 271 no grupo placebo) – com 2 casos no grupo da vacina Pfizer-BioNTech, em comparação com 5 no grupo placebo. No entanto, a eficácia da vacina foi enquadrada pela FDA em 80,4%, e o documento conclui que “os dados disponíveis suportam a eficácia da série primária de 3 doses da vacina Pfizer-BioNTech COVID-19 (3 µg cada dose) na prevenção da COVID-19 na faixa etária de 6 meses a 4 anos”. Além disso, o documento afirma que “Entre lactentes e crianças de 6 meses a 4 anos de idade, as taxas de hospitalização e morte por COVID-19 são maiores do que entre crianças e adolescentes de 5 a 17 anos e comparáveis a indivíduos de 18 a 17 anos. 25 anos de idade, ressaltando o benefício de uma vacina COVID19 eficaz nessa faixa etária”.
Quão ético é dar a um bebê uma vacina para uma doença em que as chances de ficar gravemente doente ou morrer são quase zero, enquanto os benefícios do tratamento não são claros e as reações adversas com risco de vida são muito significativas?
Essa questão foi tema de um artigo publicado em março deste ano na Bioethics . Os pesquisadores afirmaram que nem mesmo uma das principais alegações argumentadas para justificar a aprovação para bebês é válida. Segundo eles, os benefícios da vacina para crianças saudáveis são mínimos e, portanto, embora as complicações sejam raras, superam os benefícios da vacina, especialmente porque não é muito claro quais são os riscos a curto e longo prazo e a experiência com a vacina é muito curta. A pretensão altruísta de proteger o meio ambiente também é muito problemática, pois como existe vacina, os grupos de risco podem se defender, e já foi comprovado que as crianças não são os principais transmissores do vírus.
Membros do Congresso exigem respostas
Essa questão ética foi levantada nos últimos dias por 18 membros do Congresso em uma carta enviada ao FDA em 7 de junho, exigindo respostas antes da decisão da autoridade de conceder uma permissão de emergência para a vacina infantil. Membros do Congresso exigiram saber por que as vacinas COVID-19 são necessárias para essa faixa etária, tendo em vista que a doença representa um risco muito pequeno para bebês e crianças pequenas, que as vacinas têm pouca eficácia e que há muitas perguntas não respondidas sobre segurança e eventos adversos dessas vacinas.
A carta apresenta 19 perguntas ao FDA, incluindo, entre outras – por que o FDA atrasou a publicação das centenas de milhares de páginas de dados dos estudos dos fabricantes, o estado dos eventos adversos e quando todos os dados do FDA podem ser ser tornado público? A FDA também foi solicitada a fornecer ao público mais detalhes sobre crianças gravemente feridas ou mortas por COVID-19 e quantas crianças em geral ficaram gravemente doentes. Os legisladores também abordaram a questão dos riscos cardíacos na administração de vacinas de mRNA COVID-19 a crianças, observando que após as vacinações administradas a um grande número de crianças de 5 a 18 anos, observou-se um aumento de miocardite e pericardite, com alguns casos terminando em morte, e os efeitos a longo prazo da inflamação relacionada ao coração ainda não quantificados pelas autoridades de saúde. O que mais,

A FDA não poderá argumentar que não sabia
Conforme declarado, os dados emergentes da análise apresentada neste artigo demonstram, sem sombra de dúvida, que a vacina não é segura para bebês e crianças pequenas. Se essas crianças fizeram parte do estudo ou não – esses relatórios estão no sistema VAERS há muitos meses, então não há chance de que o FDA não os conheça. Infelizmente, o fato de a FDA estar ciente de pelo menos alguns dos eventos adversos graves, incluindo aumento do risco de morbidade nos primeiros dias após a vacinação, miocardite e aumento do risco de aborto espontâneo e malformações fetais, e ainda ter aprovado a vacina para adolescentes, crianças e mulheres grávidas, foi revelado tarde demais – muito tempo depois que os EUA foram concedidos à Pfizer e à Moderna, quando muitos já foram prejudicados. Só ficou claro graças aos pedidos da FOIA (Freedom of Information) submetidos ao FDA e outras autoridades de saúde, e somente depois que o FDA foi forçado pelo tribunal a divulgar os documentos. Desta vez, os dados do VAERS aqui apresentados permitem revelar esse fato antes mesmo da aprovação. A FDA não poderá alegar que não sabia.

Um comentário:
Fui obrigado a me vacinar por causa do trabalho. Mesmo assim não tomei a PFIZER. Escolhi a CORONAVAC.
Postar um comentário